Endoterma och exoterma reaktioner
Pluggdriven, 8 februari 2022När en reaktion inträffar kan den antingen avge värme till sin omgivning eller ta upp värme från sin omgivning. Dessa olika typerna är reaktioner är det vi kallar för exoterma- och endoterma reaktioner.
En exoterma reaktion innebär att den avger energi till sin omgivning, medan en endoterm reaktion innebär att den tar upp energi från sin omgivning.
Ett viktigt begrepp när det gäller reaktioner är entalpi vilket är den kemiska bundna energin. Entalpi betecknas med H och har enheten Joule (J). När man pratar om entalpi så är entalpiändringen väldigt viktig. Den definieras som skillnaden mellan produkternas sammanlagda entalpi och reaktanternas sammanlagda entalpi och betecknas med .
Exoterma reaktioner
Exoterma reaktioner är reaktioner som kommer avge energi till omgivningen. Exoterma reaktioner kommer också att ha ett negativt entalpi-värde eftersom energi avges till omgivningen i form av värme.
Ett exempel på en exoterm reaktion är när syrgas reagerar med kol och bildar.
För att visa på entalpiändringar brukar man använda sig utav entalpidiagram som visar förändringen av energin. För exoterma reaktioner ser man att entalpin minskar enligt:
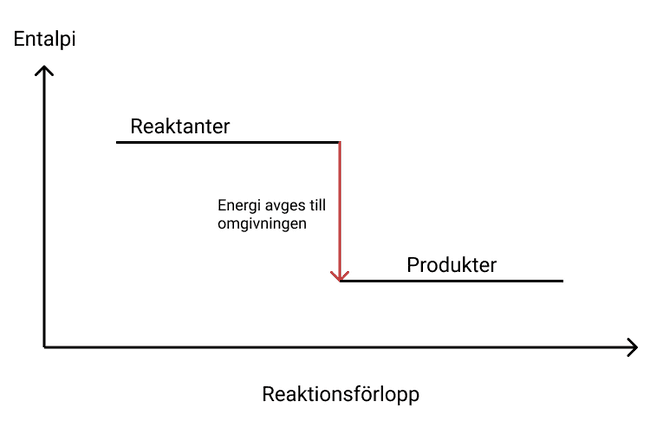
Endoterma reaktioner
Endoterma reaktioner är reaktioner som kommer ta upp energi till omgivningen. Endoterma reaktioner kommer också att ha ett positivt entalpi-värde eftersom energi tas upp från omgivningen.
Ett typiskt exempel på en endoterm reaktion är fotosyntes, där koldioxid och vatten omvandlas till druvsocker och syre.
Entalpidiagrammet för en endoterm reaktioner kommer visa att entalpin ökat. Nedan ser du ett entalpidiagram för en endoterm reaktion.
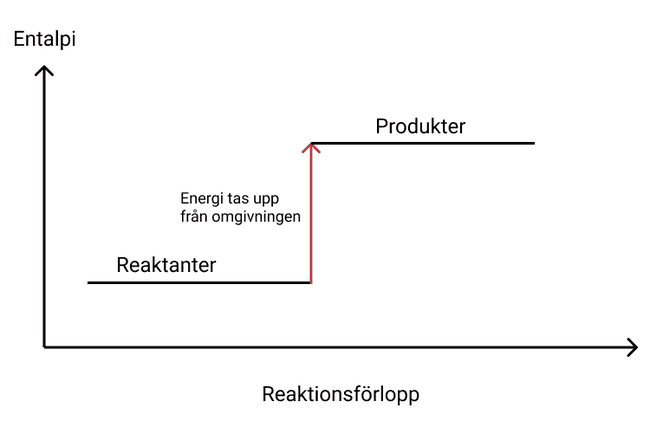
Aktiveringsenergi
Inga reaktioner kan däremot utföras av sig själv och detta innebär också för exoterma reaktioner som avger energi.
Aktiveringsenergin är den energin som krävs för att bryta bindningarna mellan de gamla atomerna. Aktiveringsenergi är ofta i form av värme vilket gör att molekylerna kommer krocka med en högre hastighet så att bindningarna lättare kan brytas.
Aktiveringenergin går också att sänka genom att använda någon typ av katalysator. En katalysator binder med reaktanterna så att bindningar försvagas vilket underlättar reaktionen. Detta gör att inte lika mycket aktiveringsenergi behövs.
I vår kropp finns det katalysator i formen av olika enzymer, vilket är olika proteiner. Dessa hjälper vår kropp att utföra olika typer av reaktioner.
